 |
|
Kyselé a základní reakce jsou všudypřítomné. Ve vodných roztocích kyseliny zvyšují koncentraci vodíkových iontů (H+). Zásady naopak zvyšují koncentraci hydroxidových iontů (OH-). Při reakci kyseliny a zásady ve vodném roztoku se ionty H+ a OH- spojují za vzniku vody. Tyto ionty se tak vzájemně „neutralizují“:
Většina kyselin má obecný vzorec HA, kde A- je aniont, a většina zásad má tvar BOH, kde B+ je příslušný kationt. Kyseliny a zásady lze rozdělit do dvou obecných typů: silné a slabé kyseliny a zásady. Rozdíl mezi nimi je přímočarý: silná kyselina se ve vodném roztoku 100% rozkládá na proton (H+) a aniont (A-)
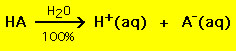
Naopak většina slabých kyselin se ve vodném roztoku rozkládá podstatně méně než na 100%:
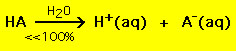 .
.Jinými slovy většina molekul slabých kyselin zůstává ve vodě neporušena. Podobné chemické rovnice platí i pro silné a slabé zásady.
Existuje pouze několik slabých kyselin a zásad, jsou to:
| |
|
|
HCl (kyselina chlorovodíková) HNO3 (kyselina dusičná) HClO4 (kyselina chlorovodíková) HClO4 (kyselina chlorovodíková) H2SO4 (kyselina sírová) |
NaOH (hydroxid sodný) KOH (hydroxid draselný) Ca(OH)2 (hydroxid vápenatý) |
Všechny ostatní kyseliny a zásady jsou slabé. Slabá kyselina vzniká z jakéhokoli aniontu. Příklady jsou uvedeny níže
| |
|
|
F- (fluorid) Br- (bromid) I- (jodid) HCO3-. (hydrogenuhličitan) C2H3O2- (octan) MnO4- (manganistan) PO4-3 (fosforečnan) CrO4-2 (chroman) CN- (kyanid) NO2- (dusitan) SO3-2 (siřičitan) |
HF (kyselina fluorovodíková) HBr (kyselina hydrobromová) HI (kyselina jodová) H2CO3 (kyselina uhličitá) HC2H3O2 (kyselina octová) HMnO4 (kyselina permanganová) H3PO4 (kyselina fosforečná) H3PO4 (kyselina fosforečná) kyselina) H2CrO4 (kyselina chromová) HCN (kyselina kyanovodíková) HNO2 (kyselina dusičná) H2SO3 (kyselina sírová) |
V typické reakci kyseliny a zásady reagují kyselina a zásada za vzniku soli a vody, např.g., kyselina kyanovodíková a hydroxid sodný:
