Výstupy z učení
- Definice oktetového pravidla a jeho role v chemické vazbě
Ne všechny prvky mají dostatek elektronů k zaplnění svých vnějších slupek, ale atom je nejstabilnější, když jsou zaplněny všechny elektronové pozice v jeho vnější slupce. Kvůli těmto volným místům v nejvzdálenějších slupkách pozorujeme vznik chemických vazeb neboli interakcí mezi dvěma nebo více stejnými nebo různými prvky, které vedou ke vzniku molekul. Aby dosáhly větší stability, budou mít atomy tendenci zcela zaplnit své vnější slupky a k dosažení tohoto cíle se budou vázat s jinými prvky sdílením elektronů, přijetím elektronů od jiného atomu nebo darováním elektronů jinému atomu. Protože vnější slupky prvků s nízkými atomovými čísly (až po vápník s atomovým číslem 20) mohou obsahovat osm elektronů, označuje se toto pravidlo jako pravidlo oktetu. Prvek může darovat, přijmout nebo sdílet elektrony s jinými prvky, aby zaplnil svou vnější slupku a splnil pravidlo oktetu.
Raný model atomu vypracoval v roce 1913 dánský vědec Niels Bohr (1885-1962). Bohrův model zobrazuje atom jako centrální jádro obsahující protony a neutrony, s elektrony v kruhových elektronových obalech v určitých vzdálenostech od jádra, podobně jako planety obíhající kolem Slunce. Každý elektronový obal má jinou energetickou hladinu, přičemž obaly nejblíže jádru mají nižší energii než obaly vzdálenější od jádra. Podle konvence se každému obalu přiřazuje číslo a symbol n – například elektronový obal nejblíže jádru se nazývá 1n. Aby se elektron mohl pohybovat mezi slupkami, musí přijmout nebo uvolnit množství energie přesně odpovídající rozdílu energií mezi slupkami. Pokud například elektron absorbuje energii z fotonu, může se excitovat a přesunout se do slupky s vyšší energií; naopak, když excitovaný elektron klesne zpět do slupky s nižší energií, uvolní energii, často ve formě tepla.
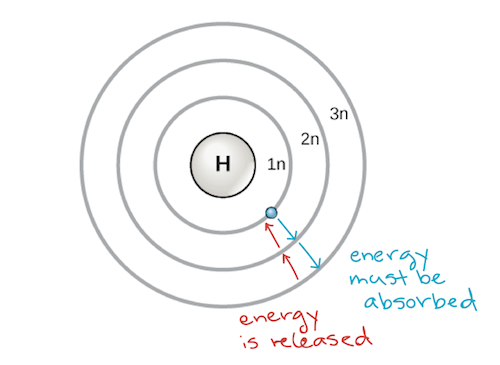
Bohrův model atomu, znázorňující energetické hladiny jako soustředné kružnice obklopující jádro. K přesunu elektronu směrem ven na vyšší energetickou hladinu je třeba dodat energii a při pádu elektronu z vyšší energetické hladiny na hladinu bližší se energie uvolňuje. Obrázek: upraveno z OpenStax Biology
Atomy, stejně jako ostatní věci, které se řídí fyzikálními zákony, mají tendenci zaujímat co nejstabilnější konfiguraci s nejnižší energií. Elektronové slupky atomu se tedy zaplňují zevnitř ven, přičemž elektrony zaplňují nízkoenergetické slupky blíže k jádru, než se přesunou do slupek s vyšší energií dále od jádra. Slupka nejblíže jádru, 1n, může obsahovat dva elektrony, zatímco další slupka, 2n, jich může obsahovat osm a třetí slupka, 3n, jich může obsahovat až osmnáct.
Počet elektronů v nejvzdálenější slupce určitého atomu určuje jeho reaktivitu neboli tendenci vytvářet chemické vazby s jinými atomy. Tato nejvzdálenější slupka se nazývá valenční slupka a elektrony, které se v ní nacházejí, se nazývají valenční elektrony. Obecně platí, že atomy jsou nejstabilnější a nejméně reaktivní, když je jejich vnější elektronová slupka plná. Většina prvků důležitých v biologii potřebuje ke své stabilitě osm elektronů v nejvzdálenější slupce a toto pravidlo je známé jako pravidlo oktetu. Některé atomy mohou být stabilní s oktetem, i když jejich valenční slupkou je slupka 3n, která může obsahovat až 18 elektronů. Důvod tohoto jevu prozkoumáme, až budeme níže probírat elektronové orbitaly.
Příklady některých neutrálních atomů a jejich elektronových konfigurací jsou uvedeny níže. V této tabulce vidíte, že helium má plný valenční obal se dvěma elektrony v prvním a jediném, 1n, obalu. Podobně neon má úplnou vnější slupku 2n obsahující osm elektronů. Díky těmto elektronovým konfiguracím jsou helium a neon velmi stabilní. Přestože argon technicky vzato nemá úplnou vnější slupku, protože slupka 3n může obsahovat až osmnáct elektronů, je stabilní stejně jako neon a helium, protože má osm elektronů ve slupce 3n, a splňuje tak pravidlo oktetu. Naproti tomu chlor má ve vnější slupce pouze sedm elektronů, zatímco sodík pouze jeden. Tyto vzory nevyplňují nejvzdálenější slupku ani nesplňují oktetové pravidlo, takže chlor a sodík jsou reaktivní a touží získat nebo ztratit elektrony, aby dosáhly stabilnější konfigurace.
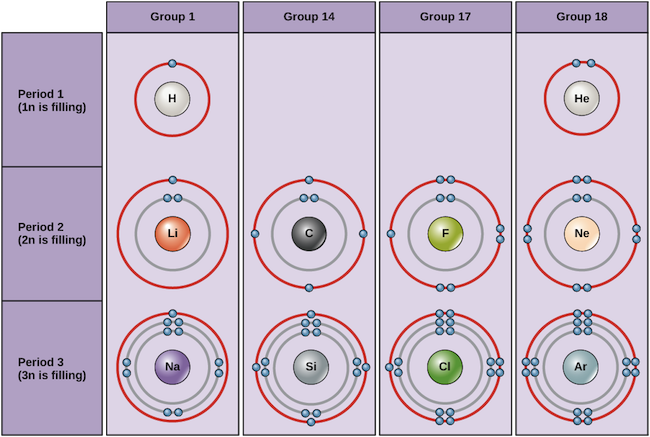
Bohrovy diagramy různých prvků Obrázek: OpenStax Biology
Elektronové konfigurace a periodická tabulka
Prvky jsou v periodické tabulce seřazeny podle atomového čísla, tedy podle toho, kolik mají protonů. V neutrálním atomu se počet elektronů bude rovnat počtu protonů, takže z atomového čísla můžeme snadno určit elektronové číslo. Kromě toho pozice prvku v periodické tabulce – jeho sloupec neboli skupina a řádek neboli perioda – poskytuje užitečné informace o tom, jak jsou tyto elektrony uspořádány.
Pokud vezmeme v úvahu pouze první tři řádky tabulky, které zahrnují hlavní prvky důležité pro život, každý řádek odpovídá zaplnění jiného elektronového obalu: helium a vodík umisťují své elektrony do obalu 1n, zatímco prvky druhého řádku jako Li začínají zaplňovat obal 2n a prvky třetího řádku jako Na pokračují obalem 3n. Podobně číslo sloupce prvku poskytuje informace o jeho počtu valenčních elektronů a reaktivitě. Obecně platí, že počet valenčních elektronů je v rámci sloupce stejný a v rámci řady se zvyšuje zleva doprava. Prvky skupiny 1 mají pouze jeden valenční elektron a prvky skupiny 18 jich mají osm, s výjimkou helia, které má celkem pouze dva elektrony. Číslo skupiny tedy dobře předpovídá, jak reaktivní budou jednotlivé prvky:
- Hélium (He), neon (Ne) a argon (Ar) jako prvky skupiny 18 mají vnější elektronové obaly plné nebo splňují pravidlo oktetu. Díky tomu jsou jako jednotlivé atomy vysoce stabilní. Pro svou nereaktivitu se nazývají inertní nebo vzácné plyny.
- Vodík (H), lithium (Li) a sodík (Na) jako prvky 1. skupiny mají ve svých vnějších slupkách pouze jeden elektron. Jako jednotlivé atomy jsou nestabilní, ale mohou se stát stabilními ztrátou nebo sdílením svého jednoho valenčního elektronu. Pokud tyto prvky zcela ztratí elektron – což Li a Na obvykle dělají – stanou se kladně nabitými ionty:
- Fluor (F) a chlor (Cl) jako prvky 17. skupiny mají ve svých vnějších slupkách sedm elektronů. Mají tendenci dosáhnout stabilního oktetu tím, že přebírají elektron od jiných atomů, a stávají se tak záporně nabitými ionty:
- Uhlík (C) jako prvek 14. skupiny má ve své vnější slupce čtyři elektrony. Uhlík obvykle sdílí elektrony, aby dosáhl úplné valenční slupky, a vytváří vazby s několika dalšími atomy.
Sloupce periodické tabulky tedy odrážejí počet elektronů, které se nacházejí ve valenční slupce každého prvku, což následně určuje, jak bude prvek reagovat.
Vyzkoušejte to
Přispějte!
Vylepšete tuto stránkuZjistěte více
