Cíle učení
- Napsat chemický vzorec pro jednoduchou iontovou sloučeninu.
- Rozpoznat víceatomové ionty v chemických vzorcích.
S některými chemickými vzorci pro jednoduché iontové sloučeniny jsme se již setkali. Chemický vzorec je stručný výčet prvků ve sloučenině a poměrů těchto prvků. Abychom lépe pochopili, co chemický vzorec znamená, musíme se zamyslet nad tím, jak je iontová sloučenina sestavena ze svých iontů.
Iontové sloučeniny existují jako střídající se kladné a záporné ionty v pravidelných trojrozměrných polích zvaných krystaly (obrázek \(\PageIndex{1}\)). Jak vidíte, v poli nejsou žádné jednotlivé „částice“ NaCl; místo toho je zde souvislá mřížka střídajících se sodíkových a chloridových iontů. Jako způsob popisu sloučeniny však můžeme použít poměr sodíkových a chloridových iontů, vyjádřený v nejnižších možných celých číslech. V případě chloridu sodného je poměr sodných a chloridových iontů, vyjádřený nejnižšími celými čísly, 1:1, takže pro vyjádření sloučeniny používáme NaCl (jeden symbol Na a jeden symbol Cl). NaCl je tedy chemický vzorec pro chlorid sodný, což je stručný způsob popisu relativního počtu různých iontů ve sloučenině. Makroskopický vzorek se skládá z myriád párů NaCl; každý pár se nazývá vzorcová jednotka. Ačkoli je vhodné si myslet, že krystaly NaCl jsou složeny z jednotlivých jednotek NaCl, obrázek \(\PageIndex{1}\) ukazuje, že žádný jednotlivý iont není výlučně spojen s žádným jiným jednotlivým iontem. Každý iont je obklopen ionty s opačným nábojem.
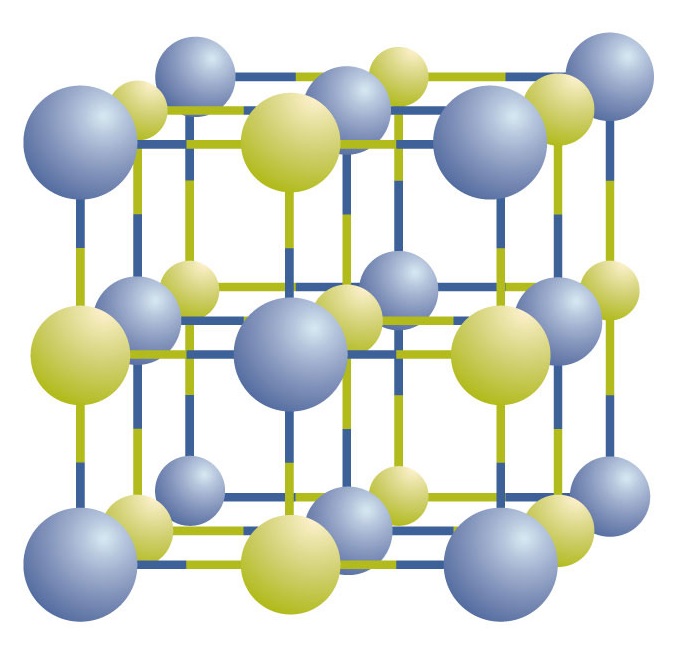
Obrázek \(\PageIndex{1}\) Krystal chloridu sodného. Krystal obsahuje trojrozměrnou soustavu střídavě kladných a záporných iontů. Přesný vzor závisí na sloučenině. Zde zobrazený krystal chloridu sodného je souborem střídajících se sodíkových a chlorových iontů.
Vzorec iontové sloučeniny se řídí několika konvencemi. Za prvé, kationt se píše před aniontem. Protože většina kovů tvoří kationty a většina nekovů anionty, uvádí se ve vzorcích obvykle nejprve kov a pak nekov. Za druhé, ve vzorci se nezapisují náboje. Pamatujte, že v iontové sloučenině jsou složkami ionty, nikoli neutrální atomy, i když vzorec neobsahuje náboje. A konečně, správný vzorec pro iontovou sloučeninu se vždy řídí následujícím pravidlem: celkový kladný náboj se musí rovnat celkovému zápornému náboji. Chcete-li určit správný vzorec libovolné kombinace iontů, určete, kolik každého iontu je potřeba k vyrovnání celkového kladného a záporného náboje ve sloučenině.
Toto pravidlo nakonec vychází ze skutečnosti, že hmota je celkově elektricky neutrální.
Podle konvence předpokládejte, že existuje pouze jeden atom, pokud není přítomen index. Jako dolní index nepoužíváme 1.
Podíváme-li se na iontovou sloučeninu složenou z iontů lithia a iontů bromidu, vidíme, že iont lithia má náboj 1+ a iont bromidu má náboj 1-. K vyrovnání těchto nábojů je zapotřebí pouze jeden iont každého z nich. Vzorec pro bromid lithný je LiBr.
Pokud je iontová sloučenina tvořena hořčíkem a kyslíkem, má iont hořčíku náboj 2+ a atom kyslíku má náboj 2-. Přestože oba tyto ionty mají vyšší náboj než ionty v bromidu lithném, stále se vzájemně vyvažují v poměru jedna ku jedné. Proto je správný vzorec této iontové sloučeniny MgO.
Nyní uvažujme iontovou sloučeninu tvořenou hořčíkem a chlorem. Ion hořčíku má náboj 2+, zatímco ion chloru má náboj 1-:
Mg2+ Cl-
Sloučením jednoho iontu každého z nich se kladné a záporné náboje zcela nevyváží. Nejjednodušší způsob, jak tyto náboje vyrovnat, je předpokládat přítomnost dvou chloridových iontů pro každý hořečnatý ion:
Mg2+ Cl- Cl-
Nyní jsou kladné a záporné náboje vyrovnány. Mohli bychom zapsat chemický vzorec pro tuto iontovou sloučeninu jako MgClCl, ale konvencí je použít číselný index, pokud existuje více než jeden iont daného typu-MgCl2. Tento chemický vzorec říká, že v něm je jeden hořečnatý ion a dva chloridové ionty. (Část vzorce „Cl2“ nečtěte jako molekulu dvouatomového prvku chloru. Chlor v této sloučenině neexistuje jako dvouatomový prvek. Spíše existuje jako dva jednotlivé chloridové ionty.) Podle konvence se ve vzorcích iontových sloučenin používá nejnižší celočíselný poměr. Vzorec Mg2Cl4 má vyrovnané náboje s ionty v poměru 1:2, ale není to nejnižší celočíselný poměr.
Podle konvence se ve vzorcích iontových sloučenin používá nejnižší celočíselný poměr iontů. U některých iontů existují výjimky, například u Hg22+
Příklad \(\PageIndex{1}\)
Napište chemický vzorec pro iontovou sloučeninu složenou z každé dvojice iontů.
- iont sodíku a ion síry
- iont hliníku a ion fluoridu
- iont železa 3+ a ion kyslíku
Roztok
- Pro získání oktetu valenčního obalu tvoří sodík ion s nábojem 1+, zatímco ion síry má náboj 2-. K vyvážení náboje 2- na iontu síry jsou zapotřebí dva ionty 1+ sodíku. Místo zápisu vzorce jako NaNaS jej podle konvence zkracujeme na Na2S.
- Hliníkový ion má náboj 3+, zatímco fluoridový ion tvořený fluorem má náboj 1-. K vyvážení náboje 3+ na iontu hliníku jsou zapotřebí tři ionty fluoru 1-. Tato kombinace se zapisuje jako AlF3.
- Železo může tvořit dva možné ionty, ale zde je uveden ion s nábojem 3+. Atom kyslíku má jako iont náboj 2-. Pro vyrovnání kladných a záporných nábojů hledáme nejméně společný násobek-6: dva ionty železa 3+ dají 6+, zatímco tři ionty kyslíku 2- dají 6-, čímž se vyrovnají celkové kladné a záporné náboje. Vzorec této iontové sloučeniny je tedy Fe2O3.
Cvičení \(\PageIndex{1}\)
Napište chemický vzorec iontové sloučeniny složené z každé dvojice iontů.
- ion vápníku a ion kyslíku
- ion mědi 2+ a ion síry
- ion mědi 1+ a ion síry
Polyatomární ionty
Některé ionty se skládají ze skupin atomů spojených dohromady a mají celkový elektrický náboj. Protože tyto ionty obsahují více než jeden atom, nazývají se polyatomické ionty. Víceatomové ionty mají charakteristické vzorce, názvy a náboje, které je třeba si zapamatovat. Například NO3- je dusičnanový ion; má jeden atom dusíku a tři atomy kyslíku a celkový náboj 1-. V tabulce \(\PageIndex{1}\) jsou uvedeny nejběžnější polyatomické ionty.
| Název | Formula |
|---|---|
| amonný ion | NH4+ |
| acetátový ion | C2H3O2- |
| karbonátový ion | CO32- |
| hydrogenuhličitanový ion (hydrogenuhličitanový ion) | HCO3- |
| kyanidový ion | CN- |
| hydroxidový ion | OH- |
| fosforečnanový ion | PO43- |
| vodíkový fosforečnanový ion | HPO42- |
| dihydrogenfosforečnanový ion | H2PO4- |
| nitrátový ion | NO3- |
| sulfitový ion | SO32- |
Pravidlo pro sestavování vzorců pro iontové sloučeniny obsahující víceatomové ionty je stejné jako pro vzorce obsahující jednoatomové (jedno-atomové) ionty: kladné a záporné náboje se musí vyrovnat. Pokud je k vyrovnání náboje zapotřebí více než jeden konkrétní víceatomový ion, musí být celý vzorec pro víceatomový ion uzavřen do závorek a číselný index se umístí mimo závorky. To má ukázat, že dílčí index se vztahuje na celý mnohoatomový ion. Příkladem je Ba(NO3)2.
Příklad \(\PageIndex{2}\)
Napište chemický vzorec pro iontovou sloučeninu složenou z každé dvojice iontů.
- draselný ion a síranový ion
- vápenatý ion a dusičnanový ion
Roztok
- Draselné ionty mají náboj 1+, zatímco síranové ionty mají náboj 2-. K vyrovnání náboje síranového iontu budeme potřebovat dva draselné ionty, takže správný chemický vzorec je K2SO4.
- Vápenaté ionty mají náboj 2+, zatímco dusičnanové ionty mají náboj 1-. K vyrovnání náboje každého vápenatého iontu budeme potřebovat dva dusičnanové ionty. Vzorec pro dusičnany musí být uveden v závorkách. Jako vzorec této iontové sloučeniny tedy píšeme Ca(NO3)2.
Cvičení \(\PageIndex{2}\)
Napište chemický vzorec iontové sloučeniny složené z každé dvojice iontů.
- hořečnatý ion a uhličitanový ion
- hlinitý ion a octanový ion
Iontové sloučeniny lze rozpoznat dvěma způsoby. Za prvé, sloučeniny mezi kovovými a nekovovými prvky jsou obvykle iontové. Například CaBr2 obsahuje kovový prvek (vápník, kov skupiny 2A) a nekovový prvek (brom, nekov skupiny 7A). Proto se s největší pravděpodobností jedná o iontovou sloučeninu. (Ve skutečnosti je iontová.) Naproti tomu sloučenina NO2 obsahuje dva prvky, které jsou oba nekovy (dusík ze skupiny 5A a kyslík ze skupiny 6A). Nejedná se o iontovou sloučeninu; patří do kategorie kovalentních sloučenin, o kterých pojednáváme na jiném místě. Všimněte si také, že tato kombinace dusíku a kyslíku nemá specifikovaný elektrický náboj, takže se nejedná o dusitanový ion.
Druhé, pokud ve sloučenině rozpoznáte vzorec víceatomového iontu, je sloučenina iontová. Pokud například uvidíte vzorec Ba(NO3)2, můžete rozpoznat část „NO3“ jako dusičnanový ion, \(\rm{NO_3^-}\). (Nezapomeňte, že konvence pro psaní vzorců pro iontové sloučeniny je neuvádět iontový náboj.) To je vodítko, že druhá část vzorce, Ba, je ve skutečnosti iont Ba2+, jehož náboj 2+ vyrovnává celkový náboj 2- ze dvou dusičnanových iontů. Tato sloučenina je tedy také iontová.
Příklad \(\PageIndex{3}\)
Určete každou sloučeninu jako iontovou nebo neiontovou.
- Na2O
- PCl3
- NH4Cl
- OF2
Roztok
- Sodík je kov a kyslík je nekov; proto se očekává, že Na2O bude iontový.
- Fosfor i chlor jsou nekovy. Proto PCl3 není iontový.
- NH4 ve vzorci představuje amonný ion, NH4+, což znamená, že tato sloučenina je iontová.
- Kyslík i fluor jsou nekovy. Proto OF2 není iontová.
Cvičení \(\PageIndex{3}\)
Určete každou sloučeninu jako iontovou nebo iontovou.
- N2O
- FeCl3
- (NH4)3PO4
- SOCl2
Přiblížení: Krev a mořská voda
Věda již dlouho ví, že krev a mořská voda mají podobné složení. Vždyť v obou kapalinách jsou rozpuštěny iontové sloučeniny. Tato podobnost může být více než pouhá náhoda; mnoho vědců se domnívá, že první formy života na Zemi vznikly v oceánech. Při bližším pohledu však zjistíme, že krev a mořská voda jsou zcela odlišné. 0,9% roztok chloridu sodného se blíží koncentraci soli, která se nachází v krvi. Naproti tomu mořská voda je v zásadě 3% roztok chloridu sodného, což je více než trojnásobek koncentrace v krvi. Zde je srovnání množství iontů v krvi a mořské vodě:
| Ion | Podíl v mořské vodě | Podíl v krvi |
|---|---|---|
| Na+ | 2.36 | 0,322 |
| Cl- | 1,94 | 0,366 |
| Mg2+ | 0,13 | 0,002 |
| SO42- | 0.09 | – |
| K+ | 0,04 | 0,016 |
| Ca2+ | 0.04 | 0,0096 |
| HCO3- | 0,002 | 0.165 |
| HPO42-, H2PO4- | – | 0,01 |
Většina iontů je v mořské vodě hojnější než v krvi, až na některé důležité výjimky. V krvi je mnohem více hydrogenuhličitanových iontů (HCO3-) než v mořské vodě. Tento rozdíl je významný, protože hydrogenuhličitanové ionty a některé příbuzné ionty hrají klíčovou roli při řízení acidobazických vlastností krve. Množství hydrogenfosforečnanových iontů – HPO42- a H2PO4 – je v mořské vodě velmi nízké, ale v krvi, kde rovněž ovlivňují acidobazické vlastnosti, jsou přítomny ve větším množství. Dalším významným rozdílem je, že krev neobsahuje významné množství síranového iontu (SO42-), ale tento ion je přítomen v mořské vodě.
Klíčové poznatky
- Správné chemické vzorce pro iontové sloučeniny vyrovnávají celkový kladný náboj s celkovým záporným nábojem.
- Existují také skupiny atomů s celkovým nábojem, které se nazývají mnohoatomové ionty.
Přispěvatelé a atributy
-
Anonymní
.
