Resultados de aprendizaje
- Define la regla del octeto y su papel en los enlaces químicos
No todos los elementos tienen suficientes electrones para llenar sus capas más externas, pero un átomo es más estable cuando todas las posiciones de los electrones en la capa más externa están llenas. Debido a estas vacantes en las capas más externas, vemos la formación de enlaces químicos, o interacciones entre dos o más elementos iguales o diferentes que dan lugar a la formación de moléculas. Para lograr una mayor estabilidad, los átomos tienden a llenar completamente sus capas exteriores y se unen a otros elementos para lograr este objetivo compartiendo electrones, aceptando electrones de otro átomo o donando electrones a otro átomo. Debido a que las capas más externas de los elementos con números atómicos bajos (hasta el calcio, con número atómico 20) pueden contener ocho electrones, esto se conoce como la regla del octeto. Un elemento puede donar, aceptar o compartir electrones con otros elementos para llenar su capa exterior y satisfacer la regla del octeto.
Un primer modelo del átomo fue desarrollado en 1913 por el científico danés Niels Bohr (1885-1962). El modelo de Bohr muestra el átomo como un núcleo central que contiene protones y neutrones, con los electrones en capas circulares de electrones a distancias específicas del núcleo, similares a los planetas que orbitan alrededor del sol. Cada cáscara de electrones tiene un nivel de energía diferente, siendo las más cercanas al núcleo más bajas en energía que las más alejadas del mismo. Por convención, a cada capa se le asigna un número y el símbolo n; por ejemplo, la capa de electrones más cercana al núcleo se llama 1n. Para moverse entre las capas, un electrón debe absorber o liberar una cantidad de energía que corresponda exactamente a la diferencia de energía entre las capas. Por ejemplo, si un electrón absorbe energía de un fotón, puede excitarse y pasar a una envoltura de mayor energía; a la inversa, cuando un electrón excitado desciende a una envoltura de menor energía, liberará energía, a menudo en forma de calor.
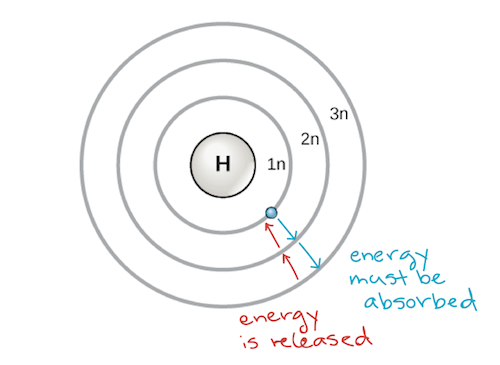
Modelo de Bohr de un átomo, que muestra los niveles de energía como círculos concéntricos que rodean el núcleo. Hay que añadir energía para mover un electrón hacia fuera a un nivel de energía más alto, y se libera energía cuando un electrón cae desde un nivel de energía más alto a uno más cercano. Crédito de la imagen: modificado de OpenStax Biology
Los átomos, al igual que otras cosas gobernadas por las leyes de la física, tienden a adoptar la configuración más estable y de menor energía que puedan. Así, las capas de electrones de un átomo se pueblan de dentro a fuera, con electrones que llenan las capas de baja energía más cercanas al núcleo antes de pasar a las capas de mayor energía más alejadas. La capa más cercana al núcleo, 1n, puede contener dos electrones, mientras que la siguiente capa, 2n, puede contener ocho, y la tercera capa, 3n, puede contener hasta dieciocho.
El número de electrones en la capa más externa de un átomo particular determina su reactividad, o la tendencia a formar enlaces químicos con otros átomos. Esta capa más externa se conoce como capa de valencia, y los electrones que se encuentran en ella se denominan electrones de valencia. En general, los átomos son más estables, menos reactivos, cuando su capa de electrones más externa está llena. La mayoría de los elementos importantes en biología necesitan ocho electrones en su capa más externa para ser estables, y esta regla general se conoce como la regla del octeto. Algunos átomos pueden ser estables con un octeto aunque su capa de valencia sea la 3n, que puede contener hasta 18 electrones. Exploraremos la razón de esto cuando hablemos de los orbitales de los electrones más adelante.
A continuación se muestran ejemplos de algunos átomos neutros y sus configuraciones electrónicas. En esta tabla, puedes ver que el helio tiene una capa de valencia completa, con dos electrones en su primera y única capa, 1n. Del mismo modo, el neón tiene una capa externa 2n completa que contiene ocho electrones. Estas configuraciones electrónicas hacen que el helio y el neón sean muy estables. Aunque técnicamente el argón no tiene una capa exterior completa, ya que la capa 3n puede contener hasta dieciocho electrones, es estable como el neón y el helio porque tiene ocho electrones en la capa 3n y, por tanto, cumple la regla del octeto. En cambio, el cloro sólo tiene siete electrones en su capa más externa, mientras que el sodio sólo tiene uno. Estos patrones no llenan la capa más externa ni satisfacen la regla del octeto, lo que hace que el cloro y el sodio sean reactivos, deseosos de ganar o perder electrones para alcanzar una configuración más estable.
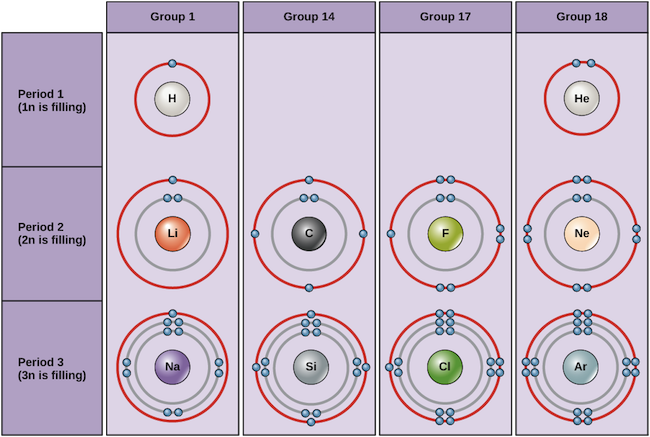
Diagramas de Bohr de varios elementos Image credit: OpenStax Biology
Configuraciones de electrones y la tabla periódica
Los elementos se colocan en orden en la tabla periódica en función de su número atómico, de cuántos protones tienen. En un átomo neutro, el número de electrones será igual al número de protones, por lo que podemos determinar fácilmente el número de electrones a partir del número atómico. Además, la posición de un elemento en la tabla periódica -su columna, o grupo, y su fila, o período- proporciona información útil sobre cómo están dispuestos esos electrones.
Si consideramos sólo las tres primeras filas de la tabla, que incluyen los principales elementos importantes para la vida, cada fila corresponde al llenado de una capa de electrones diferente: el helio y el hidrógeno colocan sus electrones en la capa 1n, mientras que los elementos de la segunda fila, como el Li, empiezan a llenar la capa 2n, y los elementos de la tercera fila, como el Na, continúan con la capa 3n. Del mismo modo, el número de columna de un elemento da información sobre su número de electrones de valencia y su reactividad. En general, el número de electrones de valencia es el mismo dentro de una columna y aumenta de izquierda a derecha dentro de una fila. Los elementos del grupo 1 tienen un solo electrón de valencia y los del grupo 18 tienen ocho, excepto el helio, que sólo tiene dos electrones en total. Por lo tanto, el número de grupo es un buen indicador de la reactividad de cada elemento:
- El helio (He), el neón (Ne) y el argón (Ar), como elementos del grupo 18, tienen cáscaras de electrones exteriores completas o que cumplen la regla del octeto. Esto los hace muy estables como átomos individuales. Debido a su falta de reactividad, se les llama gases inertes o gases nobles.
- El hidrógeno (H), el litio (Li) y el sodio (Na), como elementos del grupo 1, tienen un solo electrón en sus capas exteriores. Son inestables como átomos individuales, pero pueden volverse estables perdiendo o compartiendo su único electrón de valencia. Si estos elementos pierden completamente un electrón -como suelen hacer el Li y el Na- se convierten en iones con carga positiva: Li+, Na+.
- El flúor (F) y el cloro (Cl), como elementos del grupo 17, tienen siete electrones en sus capas más externas. Tienden a conseguir un octeto estable tomando un electrón de otros átomos, convirtiéndose en iones con carga negativa: F- y Cl-.
- El carbono (C), como elemento del grupo 14, tiene cuatro electrones en su capa exterior. El carbono suele compartir electrones para conseguir una capa de valencia completa, formando enlaces con otros múltiples átomos.
Así, las columnas de la tabla periódica reflejan el número de electrones que se encuentran en la capa de valencia de cada elemento, lo que a su vez determina cómo reaccionará el elemento.
Prueba
¡Contribuye!
Mejora esta páginaAprende más
