Objetivos de aprendizaje
- Escribir la fórmula química de un compuesto iónico simple.
- Reconocer los iones poliatómicos en las fórmulas químicas.
Ya hemos encontrado algunas fórmulas químicas de compuestos iónicos simples. Una fórmula química es una lista concisa de los elementos de un compuesto y las proporciones de estos elementos. Para entender mejor lo que significa una fórmula química, debemos considerar cómo se construye un compuesto iónico a partir de sus iones.
Los compuestos iónicos existen como iones positivos y negativos que se alternan en arreglos regulares y tridimensionales llamados cristales (Figura \N(\PageIndex{1})). Como se puede ver, no hay «partículas» individuales de NaCl en la matriz; en su lugar, hay un entramado continuo de iones de sodio y cloruro alternados. Sin embargo, podemos utilizar la relación entre los iones de sodio y los de cloruro, expresada en los números enteros más bajos posibles, como forma de describir el compuesto. En el caso del cloruro de sodio, la relación entre los iones de sodio y los iones de cloruro, expresada en números enteros mínimos, es de 1:1, por lo que utilizamos NaCl (un símbolo de Na y un símbolo de Cl) para representar el compuesto. Así, NaCl es la fórmula química del cloruro de sodio, que es una forma concisa de describir el número relativo de los diferentes iones del compuesto. Una muestra macroscópica está compuesta por miríadas de pares de NaCl; cada par se denomina unidad de fórmula. Aunque es conveniente pensar que los cristales de NaCl están compuestos por unidades individuales de NaCl, la Figura \(\PageIndex{1}\) muestra que ningún ion está asociado exclusivamente con otro ion. Cada ión está rodeado de iones de carga opuesta.
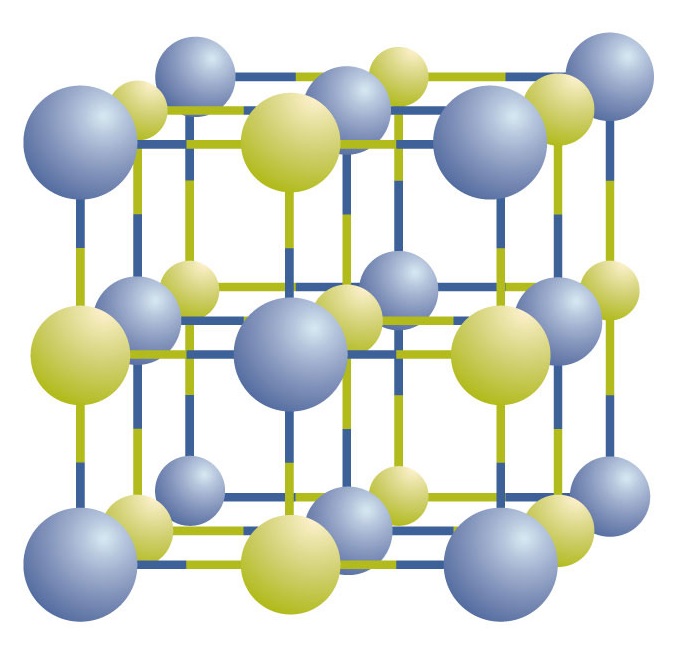
Figura \(\PageIndex{1}\) Un cristal de cloruro de sodio. Un cristal contiene una matriz tridimensional de iones positivos y negativos alternados. El patrón preciso depende del compuesto. Un cristal de cloruro de sodio, mostrado aquí, es una colección de iones de sodio y cloro alternados.
La fórmula de un compuesto iónico sigue varias convenciones. En primer lugar, el catión se escribe antes del anión. Como la mayoría de los metales forman cationes y la mayoría de los no metales forman aniones, las fórmulas suelen indicar primero el metal y luego el no metal. En segundo lugar, las cargas no se escriben en una fórmula. Recuerda que en un compuesto iónico, las especies que lo componen son iones, no átomos neutros, aunque la fórmula no contenga cargas. Por último, la fórmula correcta de un compuesto iónico siempre obedece a la siguiente regla: la carga positiva total debe ser igual a la carga negativa total. Para determinar la fórmula adecuada de cualquier combinación de iones, determine cuántos de cada ión se necesitan para equilibrar el total de cargas positivas y negativas en el compuesto.
Esta regla se basa, en última instancia, en el hecho de que la materia es, en general, eléctricamente neutra.
Por convención, asuma que sólo hay un átomo si no hay un subíndice presente. No utilizamos el 1 como subíndice.
Si observamos el compuesto iónico formado por iones de litio e iones de bromuro, vemos que el ion de litio tiene una carga 1+ y el ion de bromuro tiene una carga 1-. Sólo se necesita un ion de cada uno para equilibrar estas cargas. La fórmula del bromuro de litio es LiBr.
Cuando se forma un compuesto iónico a partir de magnesio y oxígeno, el ion magnesio tiene una carga 2+, y el átomo de oxígeno tiene una carga 2-. Aunque ambos iones tienen cargas más altas que los iones del bromuro de litio, siguen equilibrándose en una relación de uno a uno. Por lo tanto, la fórmula adecuada para este compuesto iónico es MgO.
Considere ahora el compuesto iónico formado por magnesio y cloro. Un ion de magnesio tiene una carga 2+, mientras que un ion de cloro tiene una carga 1:
Mg2+ Cl-
La combinación de un ion de cada uno no equilibra completamente las cargas positivas y negativas. La forma más fácil de equilibrar estas cargas es asumir la presencia de dos iones de cloruro por cada ion de magnesio:
Mg2+ Cl-
Ahora las cargas positivas y negativas están equilibradas. Podríamos escribir la fórmula química de este compuesto iónico como MgClCl, pero la convención es utilizar un subíndice numérico cuando hay más de un ion de un tipo determinado-MgCl2. Esta fórmula química dice que hay un ion de magnesio y dos iones de cloruro en esta fórmula. (No lea la parte «Cl2» de la fórmula como una molécula del cloro elemental diatómico. El cloro no existe como elemento diatómico en este compuesto. Más bien, existe como dos iones de cloruro individuales). Por convención, en las fórmulas de los compuestos iónicos se utiliza la menor proporción de números enteros. La fórmula Mg2Cl4 tiene cargas equilibradas con los iones en una proporción de 1:2, pero no es la proporción de números enteros más baja.
Por convención, en las fórmulas de los compuestos iónicos se utiliza la proporción de números enteros más baja de los iones. Hay excepciones para ciertos iones, como el Hg22+
Ejemplo \(\PageIndex{1})
Escriba la fórmula química de un compuesto iónico formado por cada par de iones.
- el ion sodio y el ion azufre
- el ion aluminio y el ion flúor
- el ion hierro 3+ y el ion oxígeno
Solución
- Para obtener un octeto de cáscara de valencia, el sodio forma un ion con carga 1+, mientras que el ion azufre tiene carga 2-. Se necesitan dos iones de sodio 1+ para equilibrar la carga 2 del ion de azufre. En lugar de escribir la fórmula como NaNaS, la acortamos por convención a Na2S.
- El ion aluminio tiene una carga 3+, mientras que el ion flúor formado por el flúor tiene una carga 1-. Se necesitan tres iones flúor 1- para equilibrar la carga 3+ del ion aluminio. Esta combinación se escribe como AlF3.
- El hierro puede formar dos posibles iones, pero aquí se especifica el ion con carga 3+. El átomo de oxígeno tiene una carga 2 como ion. Para equilibrar las cargas positivas y negativas, buscamos el mínimo común múltiplo-6: dos iones de hierro 3+ darán 6+, mientras que tres iones de oxígeno 2- darán 6-, equilibrando así las cargas positivas y negativas totales. Así, la fórmula de este compuesto iónico es Fe2O3.
Ejercicio \(\PageIndex{1})
Escribe la fórmula química de un compuesto iónico formado por cada par de iones.
- el ion calcio y el ion oxígeno
- el ion cobre 2+ y el ion azufre
- el ion cobre 1+ y el ion azufre
Iones poliatómicos
Algunos iones están formados por grupos de átomos unidos entre sí y tienen una carga eléctrica global. Como estos iones contienen más de un átomo, se denominan iones poliatómicos. Los iones poliatómicos tienen fórmulas, nombres y cargas características que deben ser memorizadas. Por ejemplo, NO3- es el ion nitrato; tiene un átomo de nitrógeno y tres de oxígeno y una carga global de 1. La tabla \(\PageIndex{1}) enumera los iones poliatómicos más comunes.
| Nombre | Fórmula |
|---|---|
| Ión amonio | NH4+ |
| Ión acetato | C2H3O2- |
| Ión carbonato | CO32- |
| Ión carbonato de hidrógeno (ion bicarbonato) | HCO3- |
| Ión cianuro | CN- |
| Ión hidróxido | OH- |
| Ión fosfato | PO43- |
| Ión fosfato de hidrógeno | HPO42- |
| Ión fosfato de dihidrógeno | H2PO4- |
| Ión nitrato | NO3- |
| Ión sulfito | SO32- |
La regla para construir las fórmulas de los compuestos iónicos que contienen iones poliatómicos es la misma que para las fórmulas que contienen iones monatómicos (de un soloátomos): las cargas positivas y negativas deben equilibrarse. Si se necesita más de un ion poliatómico en particular para equilibrar la carga, la fórmula completa del ion poliatómico debe ir entre paréntesis, y el subíndice numérico se coloca fuera del paréntesis. Esto es para mostrar que el subíndice se aplica a todo el ion poliatómico. Un ejemplo es Ba(NO3)2.
Ejemplo \N(\Nde la página{2})
Escriba la fórmula química de un compuesto iónico formado por cada par de iones.
- El ion potasio y el ion sulfato
- El ion calcio y el ion nitrato
Solución
- Los iones potasio tienen una carga de 1+, mientras que los iones sulfato tienen una carga de 2-. Necesitaremos dos iones de potasio para equilibrar la carga del ion sulfato, por lo que la fórmula química adecuada es K2SO4.
- Los iones de calcio tienen una carga de 2+, mientras que los iones de nitrato tienen una carga de 1-. Necesitaremos dos iones de nitrato para equilibrar la carga de cada ion de calcio. La fórmula del nitrato debe ir entre paréntesis. Así pues, escribimos Ca(NO3)2 como fórmula de este compuesto iónico.
Ejercicio \N(\N- ÍndiceDePágina{2})
Escribe la fórmula química de un compuesto iónico formado por cada par de iones.
- el ion magnesio y el ion carbonato
- el ion aluminio y el ion acetato
Reconociendo los compuestos iónicos
Hay dos formas de reconocer los compuestos iónicos. En primer lugar, los compuestos entre elementos metálicos y no metálicos suelen ser iónicos. Por ejemplo, CaBr2 contiene un elemento metálico (calcio, un metal del grupo 2A) y un elemento no metálico (bromo, un no metal del grupo 7A). Por lo tanto, lo más probable es que sea un compuesto iónico. (De hecho, es iónico.) En cambio, el compuesto NO2 contiene dos elementos que son ambos no metales (nitrógeno, del grupo 5A, y oxígeno, del grupo 6A). No es un compuesto iónico, sino que pertenece a la categoría de los compuestos covalentes de los que hablamos en otro apartado. Observe también que esta combinación de nitrógeno y oxígeno no tiene carga eléctrica especificada, por lo que no es el ion nitrito.
Segundo, si reconoce la fórmula de un ion poliatómico en un compuesto, el compuesto es iónico. Por ejemplo, si ve la fórmula Ba(NO3)2, es posible que reconozca la parte «NO3» como el ion nitrato, \rm{NO_3^-}\rm). (Recuerda que la convención para escribir las fórmulas de los compuestos iónicos es no incluir la carga iónica). Esto es una pista de que la otra parte de la fórmula, Ba, es en realidad el ion Ba2+, con la carga 2+ que equilibra la carga total de 2 de los dos iones de nitrato. Por lo tanto, este compuesto también es iónico.
Ejemplo \(\PageIndex{3})
Identifique cada compuesto como iónico o no iónico.
- Na2O
- PCl3
- NH4Cl
- OF2
Solución
- El sodio es un metal, y el oxígeno es un no metal; por lo tanto, se espera que el Na2O sea iónico.
- Tanto el fósforo como el cloro son no metales. Por lo tanto, PCl3 no es iónico.
- El NH4 en la fórmula representa el ion amonio, NH4+, lo que indica que este compuesto es iónico.
- Tanto el oxígeno como el flúor son no metales. Por lo tanto, OF2 no es iónico.
Ejercicio (\NIndicePágina{3})
Identificar cada compuesto como iónico o no iónico.
- N2O
- FeCl3
- (NH4)3PO4
- SOCl2
Mirando más de cerca: La sangre y el agua de mar
La ciencia ha reconocido desde hace tiempo que la sangre y el agua de mar tienen composiciones similares. Después de todo, ambos líquidos tienen compuestos iónicos disueltos. La similitud puede ser más que una mera coincidencia; muchos científicos piensan que las primeras formas de vida en la Tierra surgieron en los océanos. Sin embargo, un examen más detallado muestra que la sangre y el agua de mar son bastante diferentes. Una solución de cloruro sódico al 0,9% se aproxima a la concentración de sal que se encuentra en la sangre. En cambio, el agua de mar es principalmente una solución de cloruro de sodio al 3%, más de tres veces la concentración en la sangre. He aquí una comparación de las cantidades de iones en la sangre y el agua de mar:
| Ión | Porcentaje en el agua de mar | Porcentaje en la sangre |
|---|---|---|
| Na+ | 2.36 | 0,322 |
| Cl- | 1,94 | 0,366 |
| Mg2+ | 0,13 | 0,002 |
| SO42- | 0.09 | – |
| K+ | 0.04 | 0.016 |
| Ca2+ | 0.04 | 0.0096 |
| HCO3- | 0.002 | 0.165 |
| HPO42-, H2PO4- | – | 0,01 |
La mayoría de los iones son más abundantes en el agua de mar que en la sangre, con algunas excepciones importantes. Hay muchos más iones de carbonato de hidrógeno (HCO3-) en la sangre que en el agua de mar. Esta diferencia es significativa porque el ion carbonato de hidrógeno y algunos iones relacionados tienen un papel crucial en el control de las propiedades ácido-base de la sangre. La cantidad de iones fosfato de hidrógeno -HPO42- y H2PO4- en el agua de mar es muy baja, pero están presentes en mayores cantidades en la sangre, donde también afectan a las propiedades ácido-base. Otra diferencia notable es que la sangre no tiene cantidades significativas del ión sulfato (SO42-), pero este ión está presente en el agua de mar.
Consignas clave
- Las fórmulas químicas adecuadas para los compuestos iónicos equilibran la carga positiva total con la carga negativa total.
- También existen grupos de átomos con una carga total, llamados iones poliatómicos.
Contribuidores y atribuciones
-
Anónimo
.
