Introducción de la ciclina
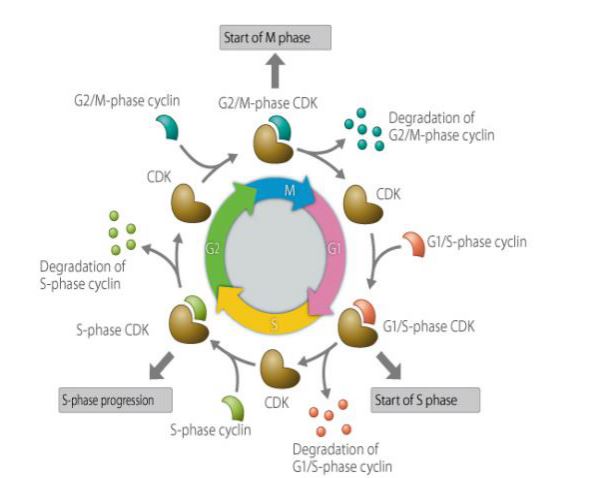
La ciclina es un tipo de proteína que se expresa, se acumula y se descompone en el ciclo celular, e interactúa con las quinasas dependientes de ciclina para afectar la función del ciclo celular. La ciclina está implicada en las proteínas reguladas por el ciclo celular, y su concentración es cíclica en el ciclo celular. Dependiendo de la etapa del ciclo celular, a veces la concentración es tan alta como varios miles de veces, y a veces cae a cero. Como subunidad reguladora, la ciclina se une a las proteínas quinasas dependientes de ciclina y las activa. Diferentes ciclinas se expresan en diferentes periodos del ciclo celular. En las células de mamíferos, la ciclina A comienza a expresarse y a acumularse gradualmente en la fase G1 temprana, alcanzando la unión G1/S, y el contenido alcanza el máximo y se mantiene en la fase G2/M. La ciclina B se expresa desde la fase G1 tardía y se acumula gradualmente. Alcanza el máximo en la fase G2 tardía y se mantiene hasta la mitad de la fase M, y luego se degrada rápidamente. La ciclina D, que es una ciclina de la fase G1, se expresa continuamente en el ciclo celular, mientras que la ciclina E comienza a expresarse y se acumula gradualmente en la fase M tardía y en la fase G1 temprana, alcanzando el máximo en la fase G1 tardía, y luego alcanza gradualmente su contenido máximo, disminuyendo hasta la fase G2 tardía. La ciclina desempeña un papel importante en la regulación del ciclo celular. El estudio del mecanismo de las ciclinas tiene una gran importancia para el tratamiento del cáncer.
Miembros de la familia de las ciclinas y sus funciones respectivamente
Hasta ahora, las ciclinas humanas han sido aisladas y nombradas en un total de 8 categorías, a saber, de la A a la H, e incluyen algunas subclases (como la ciclina D1, D2, D3), de las cuales la F, G, H son las últimas descubiertas. Todas las ciclinas tienen ciertas similitudes de secuencia de aminoácidos y, por lo tanto, sirven como marcadores estructurales moleculares de las ciclinas. Esta región de aminoácidos homólogos en la ciclina es el llamado casete de ciclina, que es una región de secuencia de 100-150 aminoácidos altamente conservada entre las ciclinas de varios organismos. La ciclina humana también contiene un casete defectuoso o una región de secuencia de aminoácidos rica en residuos de prolina, ácido glutámico, ácido aspártico, serina y treonina (en lo sucesivo, región de secuencia de aminoácidos PEST). La unión de la ciclina B a la quinasa dependiente de ciclina p34CDC2 controla la entrada y salida de la mitosis, que se sintetiza desde la fase S hasta la fase G2 /M, y gradualmente se acumula y se une a p34CDC2. En la fase M, se degrada gradualmente; por el contrario, la salida de la fase M depende de la rápida degradación de la ciclina en la fase tardía de la división, lo que da lugar a la liberación de la subunidad inactiva p34CDC2. En las células humanas, la ciclina B se acumula en el citoplasma y entra en el núcleo antes de que desaparezca la membrana nuclear. Una vez activada, la ciclina B/CDC fosforila un grupo de proteínas, entre las que se encuentran la laminina, la vimentina y el calcio, que desempeñan un papel importante en la concentración de cromosomas, la desintegración de la membrana nuclear, la despolimerización de los filamentos intermedios y la reorganización de los microfilamentos. La ciclina B también desempeña un papel importante en la transición de fase de la mitosis, siendo una proteína clásica del ciclo de escisión. La ciclina A desempeña un papel en las transiciones de fase G2/M y G1/S. Aparece antes del inicio de la síntesis de ADN, y aumenta gradualmente hasta la fase de pre-escisión y se degrada en la fase media. Cuando induce la mitosis, difiere de la verdadera ciclina B mitótica en muchos aspectos. El contenido de ciclina C cambia poco a lo largo del ciclo celular, con sólo un ligero aumento a principios de G1. El ARNm de la ciclina C alcanza su máximo en la mitad de G1 en las células HeLa sincronizadas, lo que es anterior a la ciclina A, que puede tener un papel en G1. La ciclina E tiene una expresión periódica distinta en el ciclo celular, y su pico está en la transición de la fase G1 /S. Tiene la función de controlar la entrada de la célula en la fase S, que puede ser el factor limitante de la transición de la fase G1 /S. En las células de mamíferos, al igual que la ciclina A, se une a la p33CDK2, un complejo que tiene actividad quinasa de la histona H1 en las fases G1 y S tempranas, pero la ciclina A y E pueden interactuar con la proteína retinoblastoma para separar los complejos, lo que sugiere que los complejos CDK2/ciclina A o E pueden regular indirectamente la expresión génica en las fases G1 y S. La ciclina E puede intervenir en la ciclina D, que desempeña un papel importante en el inicio de la replicación del ADN, la conversión G1 /S, y su sobreexpresión acelera la entrada de la célula en la fase S. La ciclina D puede controlar la fase G1 temprana del proceso, antes o al mismo tiempo que la ciclina E. La ciclina D tiene tres subtipos (D1, D2, D3), y su expresión varía de una célula a otra, y está controlada por diferentes regiones cromosómicas (D1: 11q13; D2: 12p13; D3: 6p21). Los subtipos pueden tener efectos diferentes. Las características destacables de la ciclina D son: es inducida a expresarse como respuesta a estímulos externos, mostrando una alta inducibilidad del factor de crecimiento, actuando como un sensor del factor de crecimiento, que juega un papel importante en la vinculación de las señales externas con el ciclo celular interno. Este papel, a su vez, infiere que su expresión incontrolada hace que el ciclo celular deje de depender de los factores de crecimiento o lo haga en menor medida, pudiendo inducir el cáncer. El complejo ciclina D-CDK es el mejor candidato para la proteína quinasa del retinoblastoma (Rb) en fase G1. La ciclina D se une a la región N-terminal de la proteína Rb, fosforila a Rb en la fase G1 tardía, y la síntesis y activación de la ciclina D1 conduce a la inactivación de la fosforilación de Rb y a la regulación a la baja de la ciclina D1, y el complejo D1-CDK4 forma una retroalimentación negativa en la fase G1, que a su vez apaga la expresión de la ciclina D1. La ciclina D y Rb juegan un papel importante en la proliferación y diferenciación celular, cuando la ciclina D1 es diferente en la fase G1. En la expresión de origen, la fosforilación de Rb es más temprana de lo normal; la fase G1 se acelera, y el anticuerpo anti-ciclina D1 se microinyecta en células G1 tempranas a metafase; la mayoría de las células se detienen antes de la fase S, y la falta de Rb funcional no puede causar este bloqueo; se concluye que el papel importante de la ciclina D1 es inactivar la fosforilación de Rb, induciendo así la entrada en la fase S y la replicación del ADN. La ciclina F es la proteína ciclina más abundante (peso molecular 87 kDa), y su ARNm se expresa universalmente en varias células de tejidos humanos, y hay cambios significativos en el ciclo celular. El pico se encuentra en la fase G2, al igual que la ciclina A, y disminuye antes que el nivel de ARNm de la ciclina B. La proteína ciclina F se acumula en la fase intercelular y se destruye durante la fase de mitosis. Se encuentra en el núcleo en la mayoría de las células. La sobreexpresión o la mutación en las células humanas da lugar a una falta de regiones de la secuencia de aminoácidos PEST que conduce a un aumento en las células de la fase G2. La ciclina G es muy parecida a la ciclina B de la levadura de fisión, que desempeña un papel en la conversión G1/S, pero el ARNm de la ciclina G no tiene una dependencia celular evidente, sino que puede ser estimulada por el crecimiento celular. El factor induce y mantiene un nivel elevado. El gen de la ciclina g contiene dos sitios diferentes de unión a p53, uno de los cuales se encuentra aguas arriba del sitio de inicio de la transcripción, lo que sugiere que p53 tiene el potencial de activar eficazmente el gen de la ciclina g. La ciclina H, que es un mediador aguas abajo de p53 al menos en el efecto biológico, es una proteína con un peso molecular de 37 kD encontrada mediante el aislamiento y la purificación de la quinasa activadora de CDK (CAK).
Función de la ciclina
El estudio de la relación entre el ciclo celular y el cáncer tiene una importancia orientadora para la investigación oncológica clínica. Puede proporcionar ciertos objetivos para el tratamiento clínico, como el bloqueo de la ciclina D, o imitar la acción de los inhibidores del ciclo celular para inhibir la división de las células cancerosas, y proporcionar algunos indicadores para el diagnóstico clínico, el diagnóstico diferencial y el pronóstico. Michaelet al analizaron el reordenamiento del gen bcl-1 y la expresión de la proteína ciclina D1 en 32 casos de linfoma de células del manto, 17 casos de reordenamiento del gen bcl-1, y 24 casos de expresión citoplasmática de ciclina D1, y 40 casos del grupo de control sólo 9 casos de linfoma de células B no MCL fueron positivos. Consideran que la ciclina D1 puede utilizarse como diagnóstico diferencial del MCL y como diagnóstico diferencial del linfoma de células B. La ciclina se expresa periódicamente en el ciclo celular, y ciertos complejos específicos de ciclina-CDK son necesarios para pasar por un determinado ciclo celular, lo que sugiere que la ciclina puede utilizarse como indicador del estado proliferativo de las células. La proporción de expresión de una determinada ciclina puede predecir la proporción de células de un determinado tejido en un determinado ciclo celular. Cuanto mayor es la malignidad de las células tumorales, más grave es el desorden del ciclo celular, por lo que es posible reflejar el pronóstico de los pacientes a través de la información mostrada en el ciclo celular, y actuar como un posible indicador de pronóstico. Keyomarsi et al. utilizaron 9 casos de muestras quirúrgicas de cáncer de mama y tejidos adyacentes no cancerosos como estudios de control: En 8 casos de tejido canceroso la ciclina E se expresaba de forma anormal en calidad y cantidad, y existían al menos 3 pesos moleculares diferentes. La ciclina E estaba sobreexpresada, mientras que la c-erbB2 sólo lo está en 3 casos. Con el aumento del estadio del tumor, el contenido de la proteína ciclina E aumentó significativamente, mientras que el nivel del antígeno nuclear de células proliferantes (PCNA) sólo aumentó ligeramente. La estructura de la ciclina E se observó en 4 de los grados de estadificación más altos. Dutta et al. utilizaron anticuerpos contra la ciclina A, B y E para detectar 48 secciones de parafina de cáncer de mama y descubrieron que el índice positivo medio de la ciclina A y B aumentaba significativamente con el aumento de la fase S (P < 0,05). La ciclina A se correlacionó positivamente con el Ki-67 y con la fracción de la fase S (P < 0,05). Bellacosaet al estudiaron 51 casos de carcinoma primario de células escamosas de la laringe y realizaron un seguimiento durante 29 meses. Se cree que la amplificación del gen de la ciclina puede utilizarse como indicador pronóstico independiente del cáncer de laringe. Sin embargo, Bettiche et al. estudiaron 53 casos de cáncer de pulmón de células no pequeñas con resección quirúrgica, y 25 casos tenían sobreexpresión de ciclina D1, lo que se asoció con una pobre diferenciación tisular, menor infiltración linfocítica en el tumor y menor tasa de recurrencia local (P < 0. 05). Consideran que se necesitan estudios clínicos más amplios para comprobar en mayor medida el significado pronóstico de la expresión de ciclina D1.
Referencia
- He G, Kuang J, Koomen J, et al. Reclutamiento del antígeno nuclear de células proliferantes trimérico por las quinasas dependientes de ciclina en fase G1 tras el daño al ADN con agentes antitumorales basados en platino. British Journal of Cancer. 2013, 109(9):2378-2388.
- Gang W, Cao J, Chen P, et al. Expresión temporal y espacial de la ciclina H en lesiones de la médula espinal de ratas. Neuromolecular Medicine. 2011, 13(3):187-196.
- Ibrahim N, Nazimi A J, Ajura A J, et al. The Clinical Features and Expression of bcl-2, Cyclin D1, p53, and Proliferating Cell Nuclear Antigen in Syndromic and Nonsyndromic Keratocystic Odontogenic Tumor. Journal of Craniofacial Surgery. 2016, 27(5):1.
- Wang X, Wolgemuth D J, Baxi L V. Sobreexpresión de HOXB5, ciclina D1 y PCNA en la malformación adenomatoidea quística congénita. Fetal Diagnosis & Therapy. 2011, 29(4):315-320.
